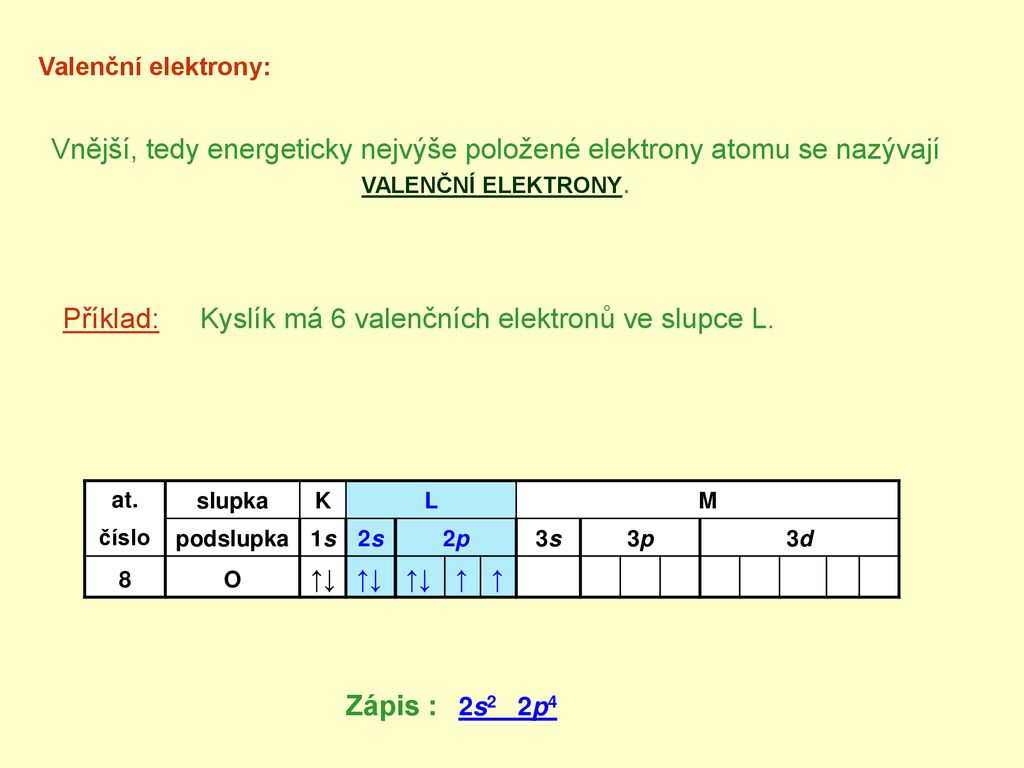
Kyslík se vyskytuje v VI. A podskupině, má tedy 6 valenčních elektronů.Pro konkrétní atom se číslo jeho valenční vrstvy shoduje s číslem periody (řádku), ve které se atom nachází v periodické tabulce objevené D. I. Mendělejevem. V tabulce jsou uvedeny prvky periodické tabulky podle jejich pořadí, které zároveň udává počet elektronů v jejich elektronovém obalu.Obecně platí, že počet valenčních elektronů je stejný jako číslo sloupce a roste v rámci řádku zleva doprava. Prvky skupiny 1 mají jeden valenční elektron a prvky skupiny 18 mají osm valenčních elektronů až na helium, které má celkem pouze dva elektrony.
Co je to volný elektronový pár : Dvojice elektronů, které jsou spárovány, ale neúčastní se chemické vazby, jsou volné elektronové páry.
Kolik elektronů ve valenční vrstvě obsahuje křemík
Křemík a germanium mají čtyři valenční elektrony, příměs má vždy buď o jeden valenční elektron méně (3. skupina), nebo o jeden valenční elektron více (5. skupina).
Kolik má valenčních elektronů síra : Síra je šestnáctým prvkem periodické soustavy. Jelikož se nachází v VI. A skupině, patří mezi tzv. "chalkogeny" (česky "rudotvorné") a má 6 valenčních elektronů.
Společně tyto částice nazýváme nukleony. Nejjednodušším atomem je atom vodíku, jehož jádro je tvořeno protonem a kolem jádra obíhá jediný elektron. Složitější atomy mají v jádře větší počet protonů a neutronů, počet obíhajících elektronů se rovná počtu protonů v jádře.
hlavní skupina, skupina boru nebo triely) jsou bor (B), hliník (Al), gallium (Ga), indium (In), thallium (Tl) a nihonium (Nh). Tato skupina leží v bloku p periodické tabulky a její prvky mají tři valenční elektrony. Elektronová konfigurace jejich valenční elektronové slupky je ns2 np1.
Kolik elektronů tvori vazbu
Chemické vazbě, která je tvořena jedním párem elektronů říkáme vazba jednoduchá. Znázorňuje se jednou čárkou mezi značkami prvků, např. H – H. Některé atomy mohou tvořit více než jednu vazbu.Elektronový pár se ve vzorci vyznačuje čárkou (čárka v elektronovém strukturním vzorci tedy znamená 2 valenční elektrony). Tato čárka se ve vzorci nachází buď na spojnici dvou atomů (pak se jedná o vazebný elektronový pár), nebo je dopsána k symbolu jednoho atomu (pak se jedná o nevazebný elektronový pár).hlavní skupina, skupina boru nebo triely) jsou bor (B), hliník (Al), gallium (Ga), indium (In), thallium (Tl) a nihonium (Nh). Tato skupina leží v bloku p periodické tabulky a její prvky mají tři valenční elektrony. Elektronová konfigurace jejich valenční elektronové slupky je ns2 np1.

Síra je šestnáctým prvkem periodické soustavy. Jelikož se nachází v VI. A skupině, patří mezi tzv. "chalkogeny" (česky "rudotvorné") a má 6 valenčních elektronů.
Kolik valenčních elektronů má med : Měď, stříbro a zlato jsou prvky I.B skupiny periodické soustavy, a tak mají plně obsazený valenční orbital typu d, eventuálně i f, a 1 elektron ve valenčním orbitalu typu s. Všechny zmíněné prvky jsou kovy,měď má oranžový a zlato žlutý lesk.
Kolik valenčních elektronů má Brom : V zápisu zkrácené elektronové konfigurace pomocí kvantových čísel je vidět, že brom má sedm valenčních elektronů (4s 2 4p 5, 2 + 5 = 7 ), lze vyčíst i z rámečkového diagramu (obsahuje 7 šipek).
Jaká je Elektronegativita kyslíku
3,44Kyslík / Elektronegativita

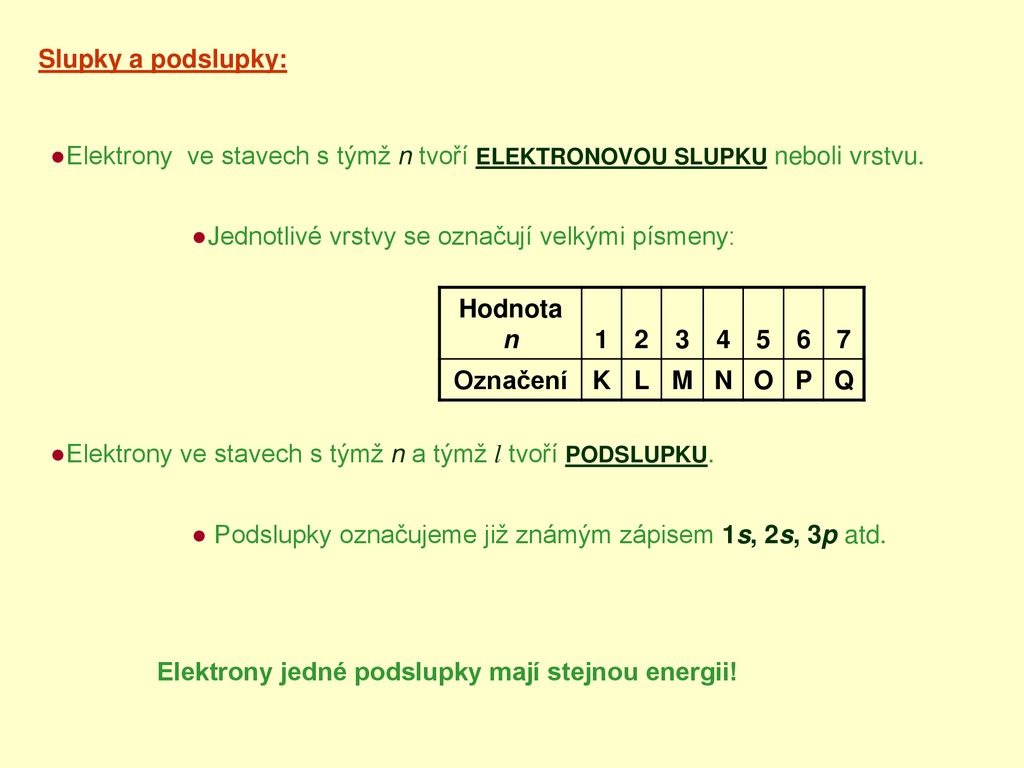
Nepolární kovalentní vazby vznikají mezi dvěma atomy téhož prvku nebo mezi atomy různých prvků, které sdílejí elektrony víceméně rovnoměrně. Například molekulární kyslík ( ) je nepolární, protože elektrony jsou mezi dvěma atomy kyslíku rozděleny rovnoměrně.Skupina všech orbitalů v atomu, které mají stejné hlavní kvantové číslo (energii mít stejnou nemusejí), se nazývá elektronová vrstva. O elektronech v atomu, které mají stejnou energii (mají stejné hlavní i vedlejší kvantové číslo), říkáme, že jsou na stejné energetické hladině.
Jaký je náboj elektronů : Elektron je subatomární částice se záporným elektrickým nábojem.



