Molární hmotnost vypočítáme z údajů v periodické soustavě prvků, s její pomocí je výpočet poměrně jednoduchý. Stačí sečíst všechny atomové hmotnosti prvků dané sloučeniny. Pokud je jeden atom ve sloučenině vícekrát (např. v H2O jsou dva atomy vodíku a jeden atom kyslíku), pak jej také do součtu přidáme vícekrát.Hmotnost molekuly kyslíku je 5,31 ∙ 10-26 kg, hmotnost molekuly amoniaku je 2,82 ∙ 10-26 kg.Výpočet. ≈ 1×10−3 kg/mol = 1 g/mol dostáváme molární hmotnost: M(H) = 1,007 97(7) × 1 g/mol = 1,007 97(7) g/mol.
Jaká je hmotnost 1 molu atomů vodíku : Jaká je hmotnost 1 molu atomů vodíku m(H) = Odpověď: 1 mol atomů vodíku má hmotnost 1,01 g.
Kolik váží jedna molekula vody
Molární hmotnost vody M(H2O) se bude skládat ze dvou molárních hmotností vodíku M(H) a jedné kyslíku M(O), protože molekula vody obsahuje dva vodíkové atomy a jeden atom kyslíkový. Jeden mol vody váží 18 g. Analogický výpočet pro kyseliny sírovou. Jeden mol kyseliny sírové váží 98 g.
Jaká je hmotnost jedné molekuly H2SO4 : Kyselina sírová H2SO4: Mr = 2 · 1,00797 + 32,064 + 4 · 15,9994 = 98,07754. Skutečná hmotnost jednoho atomu v kilogramech se vypočte m1 = Ar · mu, skutečná hmotnost jedné molekuly se vypočte m1 = Mr · mu .
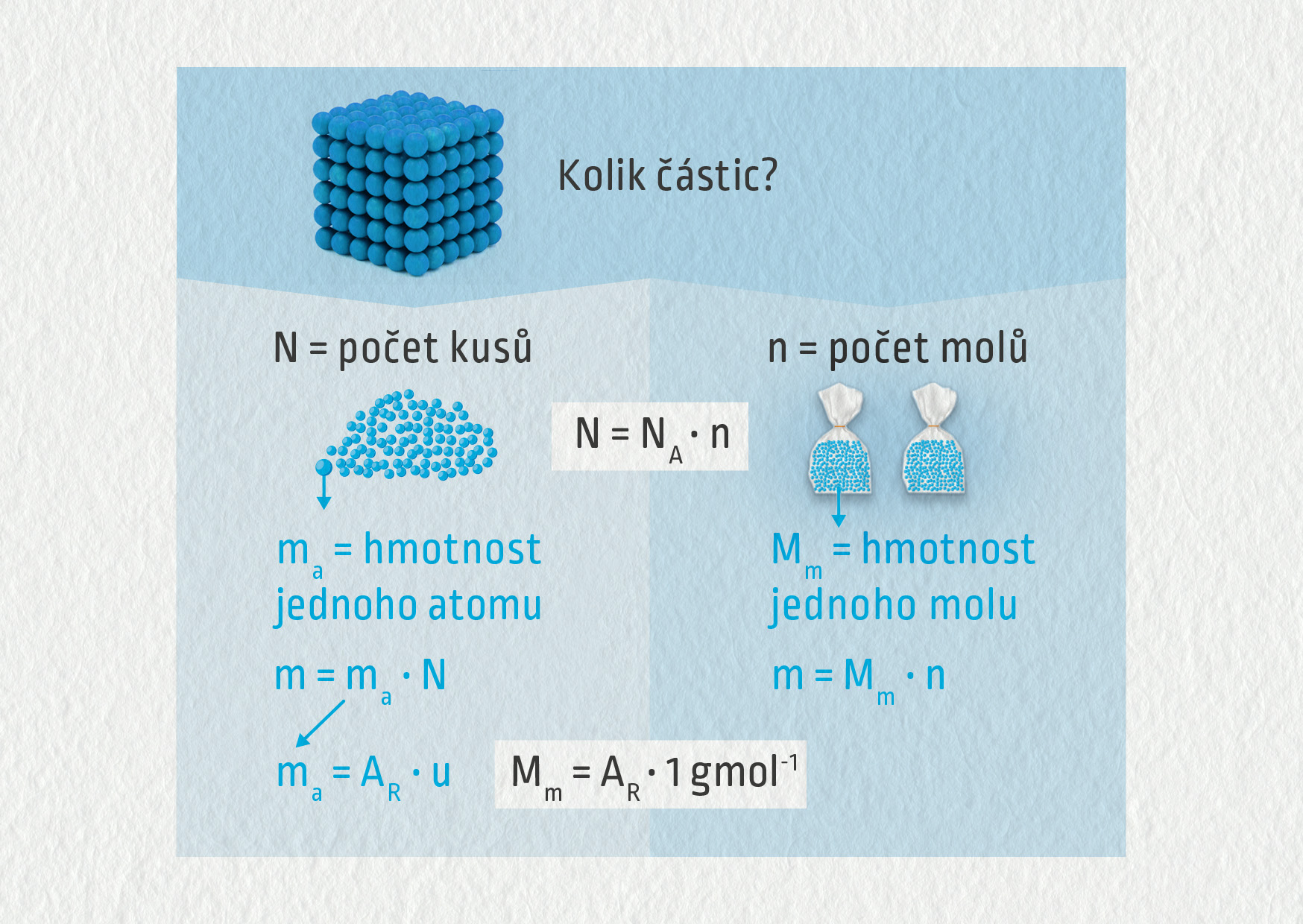
Často ve fyzice používáme molární hmotnost a molární objem. Molární hmotnost definujeme jako podíl hmotnosti dané látky a jejího látkového množství. Vyjadřuje nám, jaká hmotnost připadá na jeden mol látky. Vypočítáme ji ze vztahu M_m = \frac {m} {n}.
Molární hmotnost vody M(H2O) se bude skládat ze dvou molárních hmotností vodíku M(H) a jedné kyslíku M(O), protože molekula vody obsahuje dva vodíkové atomy a jeden atom kyslíkový. Jeden mol vody váží 18 g. Analogický výpočet pro kyseliny sírovou. Jeden mol kyseliny sírové váží 98 g.
Jak převést gramy na mol
Jak převést moly na gramy
Převádíte-li z gramů na moly, vydělte počet gramů molární hmotností.= 6,022⋅1023 N = V 5 molech molekul vody je obsaženo 3,011 . 1024 molekul vody.Jeden mol libovolné látky obsahuje přesně 6,02214076×1023 částic (atomů, molekul, iontů apod.), což je číselná hodnota Avogadrovy konstanty vyjádřené v jednotkách mol−1. Tato definice platí od 20. května 2019. 6 C je téměř přesně 12 g.
Je-li těleso ze stejnorodé látky (z téže látky, nejsou v něm bubliny) pak můžeme určit jeho hmotnost bez použití vah.
- Hmotnost stejnorodého tělesa určíme, když násobíme.
- hustotu látky, ze které je těleso, objemem tohoto tělesa:
- m = ρ × V nebo m = ρ .V.
Jaká je molární hmotnost NaCl : 58,44 g/molChlorid sodný / Molární hmotnost
Molární hmotnost NaCl je 58,44 g. mol-1.
Co je to G mol : Molární hmotnost ( M, jednotka g / m o l \mathrm{g/mol} g/mol) vyjadřuje hmotnost určitého látkového množství látky. Molární hmotnost lze spočítat na základě relativních atomových hmotností uvedených v periodické tabulce.
Co je to g mol
Molární hmotnost ( M, jednotka g / m o l \mathrm{g/mol} g/mol) vyjadřuje hmotnost určitého látkového množství látky. Molární hmotnost lze spočítat na základě relativních atomových hmotností uvedených v periodické tabulce.
Hmotnost tělesa vypočteme tak, že objem vynásobíme hustotou.Hmotnost válce
- hmotnost válce = hustota × objem válce.
- m [kg] = ρ [kg/m3] × V [m3]
Co znamená zkratka MOL : Mol (značka mol) je základní fyzikální jednotka látkového množství. Jeden mol libovolné látky obsahuje přesně 6,02214076×1023 částic (atomů, molekul, iontů apod.), což je číselná hodnota Avogadrovy konstanty vyjádřené v jednotkách mol−1. Tato definice platí od 20. května 2019.