Nejelektronegativnější jsou halogeny (v čele s fluorem), naopak nejméně elektronegativní jsou alkalické kovy.Elektronegativitu nelze přímo měřit a musí být vypočtena z jiných atomových nebo molekulárních vlastností. Vypočítává se jako průměr ionizační energie a elektronové afinity volného atomu. Není však vlastností samotného atomu, ale spíše vlastností atomu v molekule.2,55Uhlík / Elektronegativita
Porovnávali jsme elektronegativitu uhlíku a kyslíku. Vyhledali jsme hodnoty v tabulce a zjistili jsme, že uhlík má elektronegativitu 2,5 a vodík 3,5, takže rozdíl je 1. To už stačí na to, aby to byla polární kovalentní vazba. Je to polární kovalentní vazba mezi uhlíkem a kyslíkem.
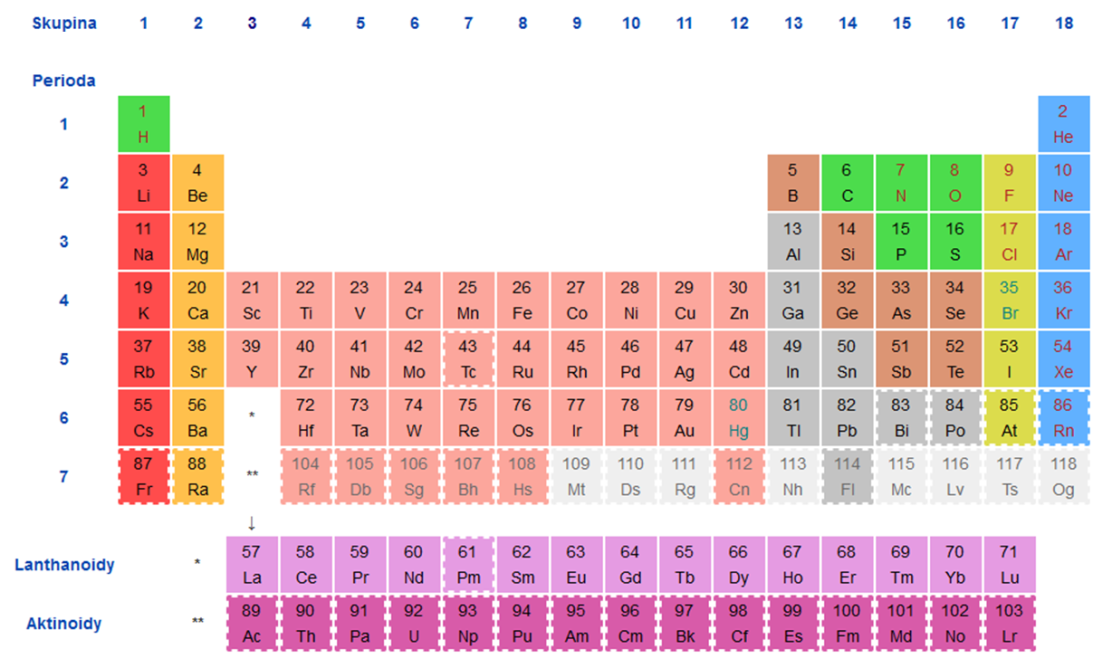
Kolik je period v PSP : Periodická tabulka má 118 prvků, 7 period a 18 skupin. První verze tabulky obsahovala 63 prvků, současná tabulka obsahuje 118 prvků, z nichž 94 se vyskytuje přirozeně na Zemi.
Jak vzniká chemická vazba
Chemické vazby vznikají a zanikají při chemických reakcích. Při tvorbě chemické vazby se uvolňuje vazebná energie, naopak pro rozštěpení chemické vazby je nutno dodat disociační energii. Energie vazebná a disociační mají stejnou velikost; čím je vazebná (disociační) energie větší, tím je vazba pevnější.
Co jsou kovalentní vazby : Kovalentní vazba (homopolární vazba nebo elektronová párová vazba) je forma chemické vazby, která je charakteristická sdílením jednoho nebo více párů elektronů mezi dvěma atomy. Tyto páry se nazývají sdílené nebo vazebné páry a zajišťují stabilní rovnováhu přitažlivých a odpuzujících sil mezi atomy.
3,44Kyslík / Elektronegativita

Valenční elektrony jsou elektrony, které atomu přebývají nad konfiguraci nejbližšího předchozího vzácného plynu. Například atom kyslíku má 6 valenčních elektronů, neboť je prvkem VI. A podskupiny a přebývá mu tedy 6 elektronů nad konfiguraci předchozího vzácného plynu (helia).
Čím se liší grafit a diamant
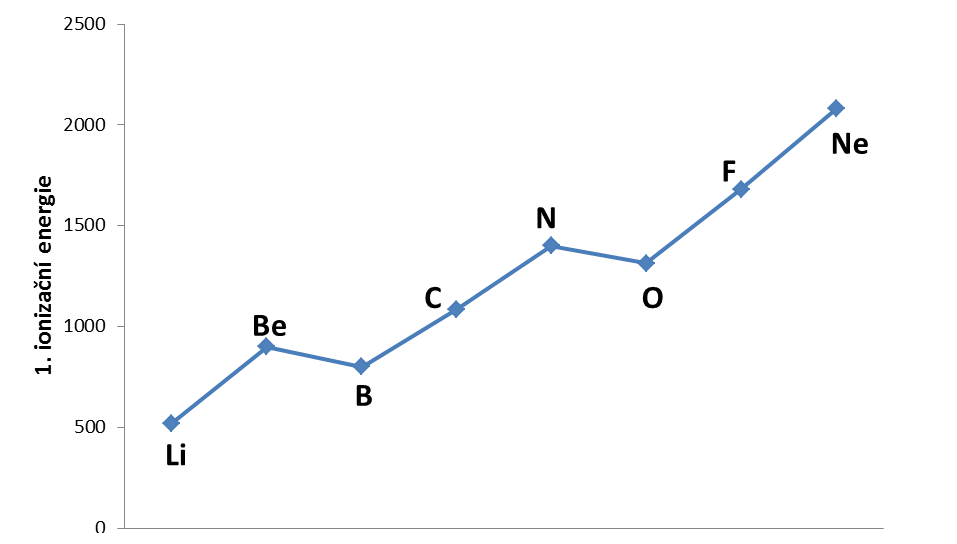
Diamanty jsou formou uhlíku, stejně jako obyčejný grafit, který najdeme v tužce. To, co diamanty odlišuje, se skrývá na úrovni atomů a jejich vazeb. Vazby diamantu jsou totiž pevnější než u grafitu a také mají jinak uspořádané atomy v krystalové mřížce.Když meteorit obsahující grafit dopadne na zem, může kolizní teplo a tlak přetvořit tuto formu uhlíku na vzácný a extrémně tvrdý typ diamantu.Nová perioda naznačuje opakování vlastností (tzn. prvky s podobnými vlastnostmi jsou v sloupečku pod sebou). Druhá perioda obsahuje tyto prvky: lithium, beryllium, bor, uhlík, dusík, kyslík, fluor a neon.
Nejnižší atomové číslo je atomové číslo vodíku , které se rovná 1. Číslo je 2 pro helium, 3 pro lithium a tak dále. Prvek, o kterém je dnes známo, že má nejvyšší atomové číslo, je prvek oganesson s atomovým číslem 118.
Která chemická vazba je nejsilnější : Kovalentní vazba, založená na sdílení elektronů, je nejsilnější z chemických vazeb. Látky s touto vazbou se obecně vyznačují slabou rozpustností, vysokou stabilitou a vysokým bodem tání. Jsou nevodivé jak v pevném stavu, tak v roztoku, jsou nerozpustné v H2O, rozpustné v nepolárních rozpouštědlech.
Jaké jsou druhy vazby : Druhy vazby
- útěková [§ 67 písm. a) trestního řádu]. Je standardně uvalena, pokud obviněný nemá na území ČR trvalý pobyt.
- kolusní [§ 67 písm. b) trestního řádu]. Je standardně uvalena, pokud vyšetřovatel dosud nevyslechl všechny svědky.
- předstižná [§ 67 písm. c) trestního řádu].
Jak vzniká sigma vazba
Vazba sigma (σ) je druh kovalentní chemické vazby, který vzniká, když dojde k maximálnímu překryvu atomových orbitalů na spojnici středů jader vázaných atomů; jedná se o nejsilnější druh kovalentní vazby. Nejsnadněji se tento typ vazby definuje pro dvouatomové molekuly, a to pomocí grup symetrie.
2,2Vodík / ElektronegativitaKyslík (chemická značka O, latinsky oxygenium) je plynný chemický prvek, tvořící druhou hlavní složku zemské atmosféry. Je biogenním prvkem a jeho přítomnost je nezbytná pro existenci většiny živých organismů na této planetě.
Jak poznat kolik má prvek valenčních elektronů : Obecně platí, že počet valenčních elektronů je stejný jako číslo sloupce a roste v rámci řádku zleva doprava. Prvky skupiny 1 mají jeden valenční elektron a prvky skupiny 18 mají osm valenčních elektronů až na helium, které má celkem pouze dva elektrony.