Oxidační čísla se značí římskými číslicemi a jejich hodnota se zapisuje vpravo nahoře za symbolem prvku. U kladných oxidačních čísel se znaménko plus nemusí zapisovat a číst, zatímco u záporných oxidačních čísel se znaménko minus vyznačuje i čte.Oxidační číslo (oxidační stav, oxidační stupeň nebo také mocenství) je elektrický náboj, který by se nacházel na atomu prvku, kdybychom elektrony v každé vazbě, které vycházejí z daného atomu, přidělili atomu s vyšší elektronegativitou.charakteristické koncovky podle oxidačního čísla prvku tzn. stačí si pamatovat jako básničku ný, natý, itý, ičitý, ičný/ečný, ový, istý, ičelý a přiřadit koncovce ný číslo 1, koncovce natý číslo 2 atd.
Jaké oxidační číslo má kyslík : Oxidační číslo kyslíku je −II, protože kyslík je elektronegativnější než síra, má větší schopnost přitahovat vazebné elektronové páry.
Jak se naucit oxidační čísla
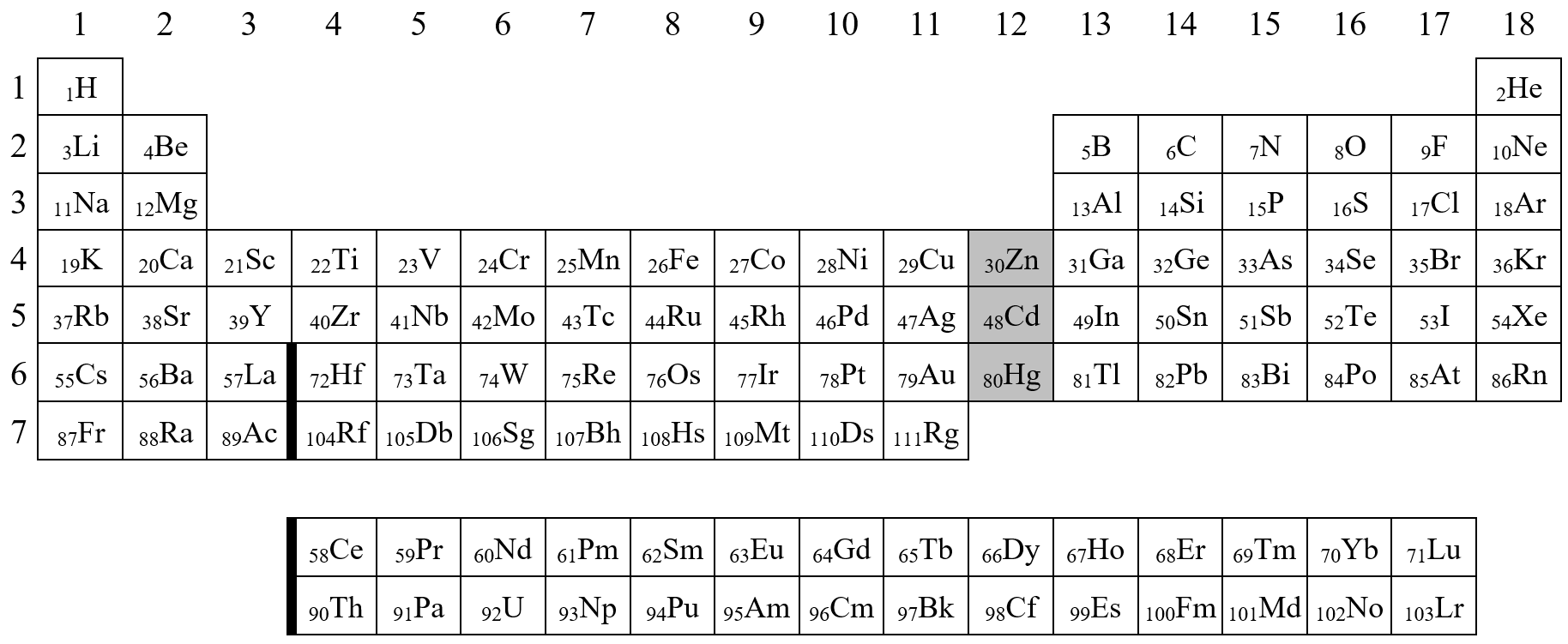
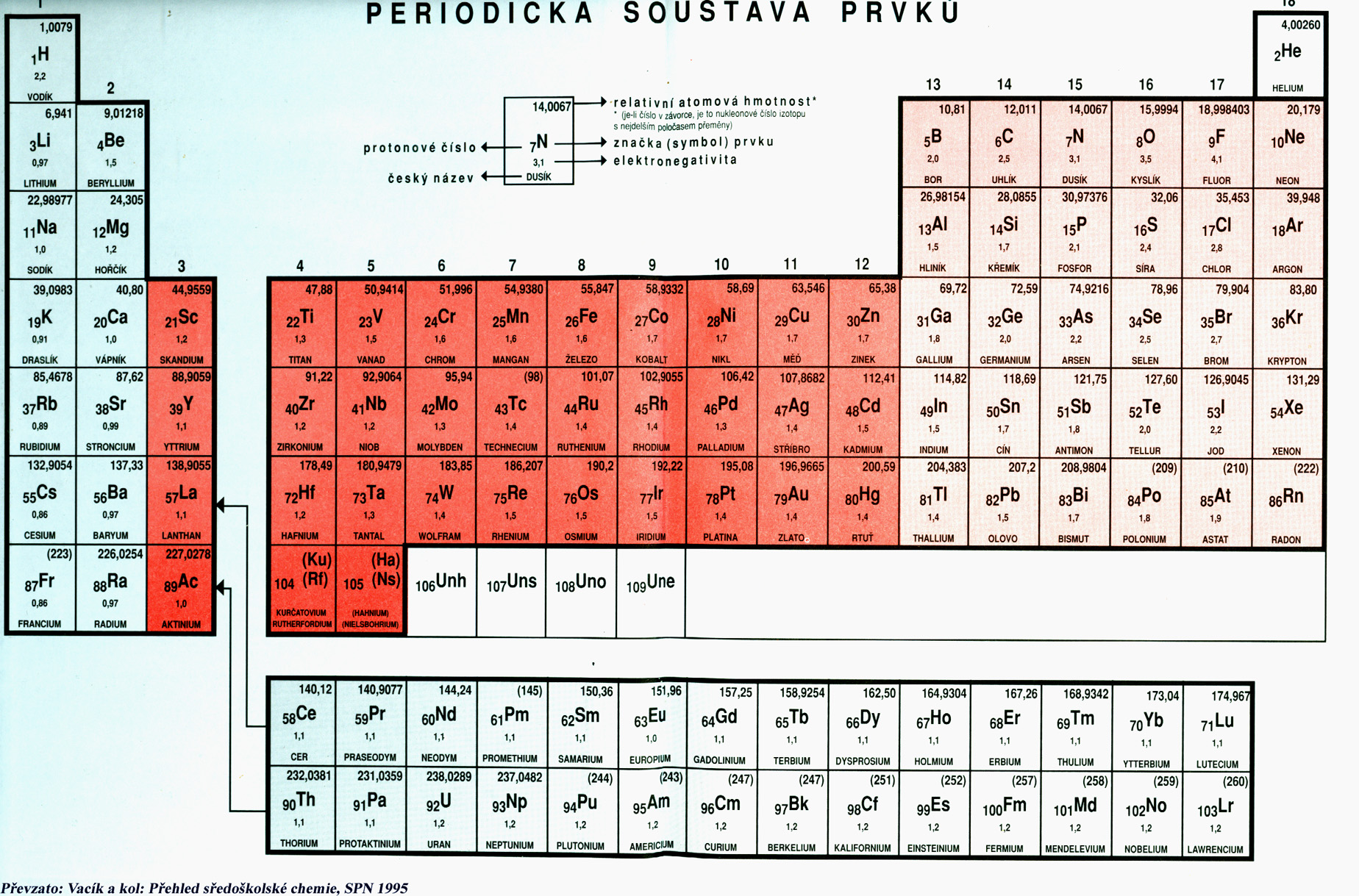
U kladných oxidačních čísel se znaménko psát ani číst nemusí, ale my jej pro větší přehlednost píšeme. U záporných oxidačních čísel se znaménko bezpodmínečně píše i čte. Oxidační čísla jednotlivých prvků můžete nalézt v periodické soustavě prvků.
Proč má kyslík oxidační číslo 2 : Proč má prvek kyslík ve sloučeninách oxidační číslo –II Kyslíku chybí 2 elektrony k zaplnění vrstvy. Po přijetí 2 elektronů bude mít 8p+ a 10e-. Náboj částice je -2,tedy oxidační číslo je –II.
Kladné hodnoty oxidačního čísla se pohybují v rozmezí od I+ do VIII+. Záporné hodnoty se pohybují v rozmezí od I- až do IV-. U kladných oxidačních čísel se znaménko psát ani číst nemusí, ale my jej pro větší přehlednost píšeme. U záporných oxidačních čísel se znaménko bezpodmínečně píše i čte.
Oxidační činidlo je látka, která přijímá elektrony od jiné látky, oxiduje ji a sama sebe redukuje. Mezi nejsilnější oxidační činidla patří prvky z pravé horní části periodické tabulky (například: fluor, kyslík, chlor) a některé sloučeniny (anorg. kyseliny, manganistany, peroxidy) a některé druhy molekul prvků (ozon).
Jaké oxidační číslo má dusík
Atom dusíku má ve své valenční vrstvě 5 elektronů. Nejvyšší oxidační číslo, které může dusík ve sloučeninách mít, je V a nejnižší -III. Díky vysoké hodnotě elektronegativity se může podílet na tvorbě vodíkových můstků. Molekuly dusíku jsou tvořeny dvěma atomy, mezi kterými je trojná vazba.Chlor může dosahovat všech lichých oxidačních čísel od -1 do +7 a samozřejmě nuly, kdy tvoří dvouatomové molekuly Cl2. Chlor je silné oxidační činidlo a reaguje s mnoha chemickými prvky (např. se sodíkem nebo železem – viz video 1 a video 2) i sloučeninami (např. s acetylenem – viz video 3).Kyslík má ve sloučeninách oxidační číslo -II. Některé prvky mají ve sloučeninách pouze tato oxidační čísla: NaI, KI ,CaII, MgII,ZnII , AlIII .
Kyslík se prakticky výlučně vyrábí destilací zkapalněného vzduchu. Vyrobený kyslík se uchovává buď ve zkapalněném stavu ve speciálních Dewarových nádobách (viz obrázek) nebo plynný v ocelových tlakových lahvích.
Jak poznat oxidační a redukční činidlo :
- oxidační činidlo – je taková látka, která má schopnost přijímat elektrony (redukovat se), jiné látky oxiduje.
- redukční činidlo – látka, která může elektrony poskytovat (oxidovat se), jiné látky redukuje.
Co to je oxidační činidlo : Oxidační činidlo je látka, která přijímá elektrony od jiné látky, oxiduje ji a sama sebe redukuje. Mezi nejsilnější oxidační činidla patří prvky z pravé horní části periodické tabulky (například: fluor, kyslík, chlor) a některé sloučeniny (anorg. kyseliny, manganistany, peroxidy) a některé druhy molekul prvků (ozon).
Jaké oxidační číslo má kyslík ve vodě
Dříve se používal název kysličník. Oxidy obsahují ve své molekule oxidový anion O2-. Oxidy vznikají odtržením 2 atomů vodíku z vody (H2O). Proto má kyslík ve všech oxidech oxidační číslo II-.
Kdykoliv se nějaká částice (atom, molekula, ion) oxiduje, odevzdává elektrony a zvyšuje své oxidační číslo. Naopak při redukci částice elektrony přijímá a její oxidační číslo se snižuje. Oxidace a redukce tedy probíhá vždy současně, zatímco jedna látka elektrony odevzdává, druhá je přijímá.Průmyslově se kyslík vyrábí destilací vzduchu zkapalněného stlačením a ochlazením. Jednotlivé složky vzduchu se liší teplotou varu. Dusík, který má lehčí molekuly, má teplotu varu -195,8 °C, zatímco kyslík s těžšími molekulami má teplotu varu -183 °C. Při zkapalňování vzduchu tedy nejdřív zkapalní kyslík.
Jak se značí kyslík : Bezbarvý plyn těžší než vzduch. Při teplotě -183 °C kondenzuje na modrou kapalinu. Tvoří jednak molekuly O2, jednak tří atomové molekuly O3 – ozon. Atomární kyslík O je obdobou atomárního vodíku.