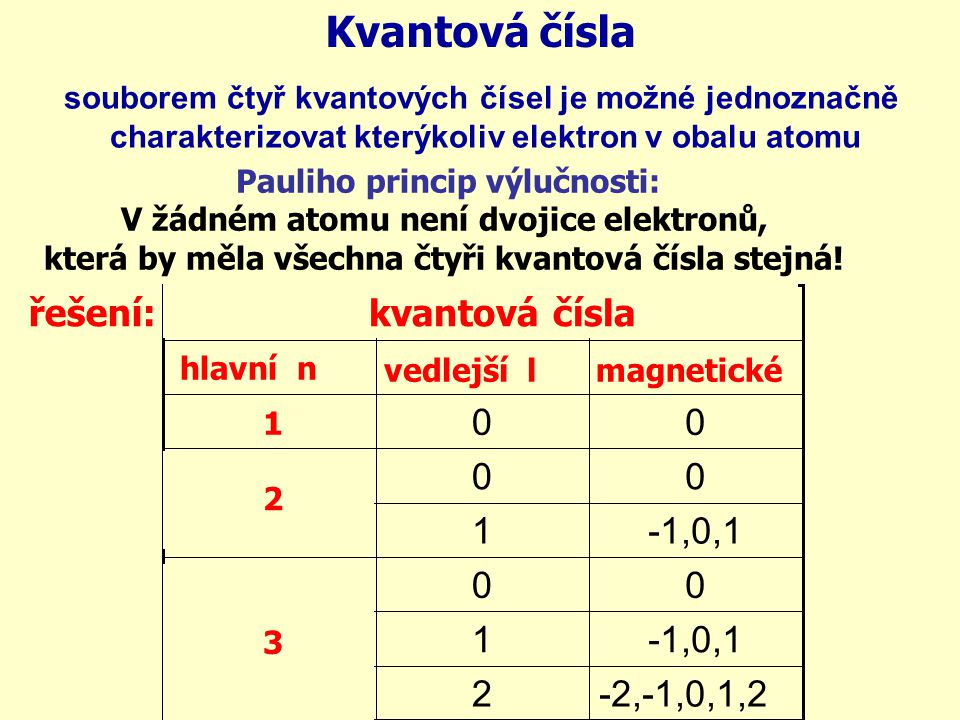
Ukážeme si, jak jsou orbitaly a elektrony v nich popisovány pomocí 4 kvantových čísel. Tuto čtveřici čísel přirovnáme pro lepší zapamatování k adrese a činnosti obyvatele obce. Uvedeme si také Pauliho princip výlučnosti, který říká, že žádné dva elektrony v atomu se nemohou shodovat ve všech 4 kvantových číslech.Kvantová čísla jsou čísla, kterými se v kvantové mechanice popisují vlastnosti určitých částic v systému; každé číslo odpovídá jedné zachovávané veličině. Nejčastějším použitím kvantových čísel je popis elektronů a jejich orbitalů v atomovém obalu, například v chemii.Hlavní kvantové číslo ( n) je přirozené číslo. Souvisí s energií elektronů a velikostí orbitalů (čím větší n, tím se elektrony mohou nacházet dále od jádra). Vedlejší kvantové číslo ( l) udává typ orbitalu, spočítá se dle vztahu l = n − 1 l = n – 1 l=n−1.
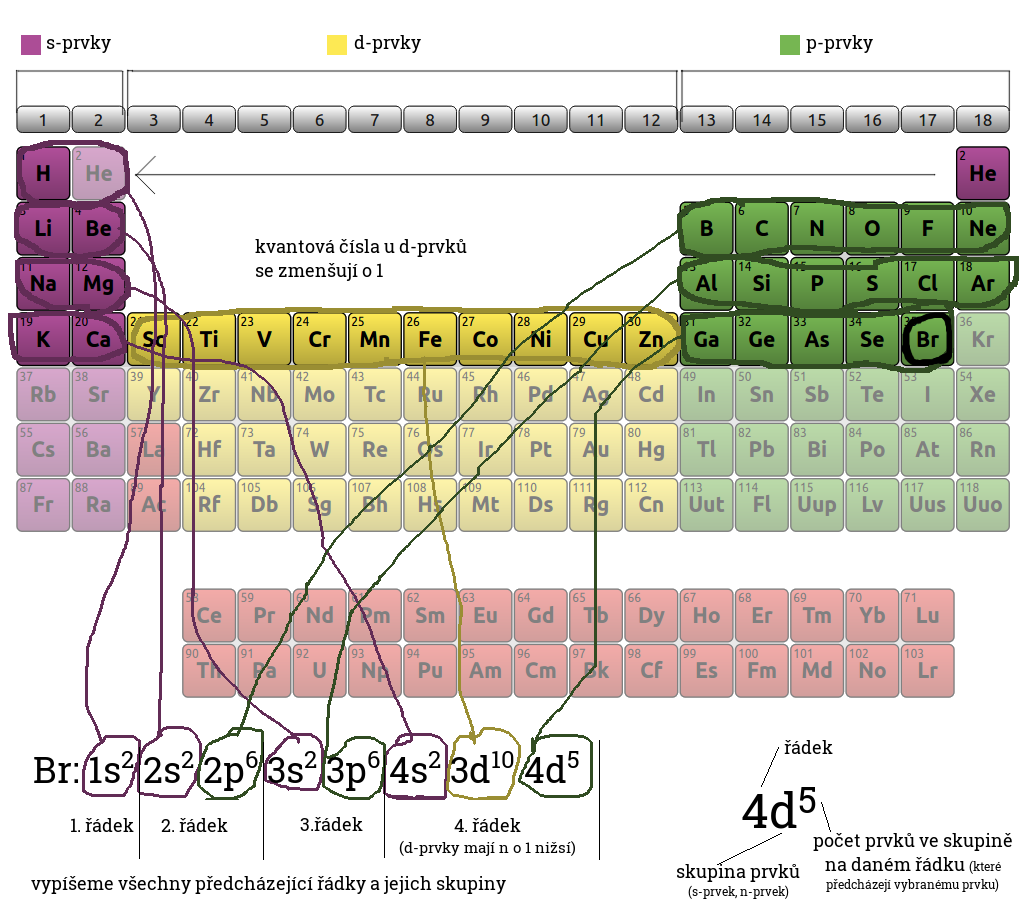
Co určuje hlavní kvantové číslo : Hlavní kvantové číslo představuje relativní celkovou energii každého orbitalu a energie každého orbitalu se zvyšuje se zvětšující se vzdáleností od atomového jádra. Sady orbitalů se stejnou hodnotou n jsou často označovány jako elektronové vrstvy nebo úrovně energie.
Co je to spinové číslo
Spinové kvantové číslo s popisuje vnitřní moment hybnosti, případně rotaci elektonu. Matematicky nabývá hodnot +0,5 nebo -0,5.
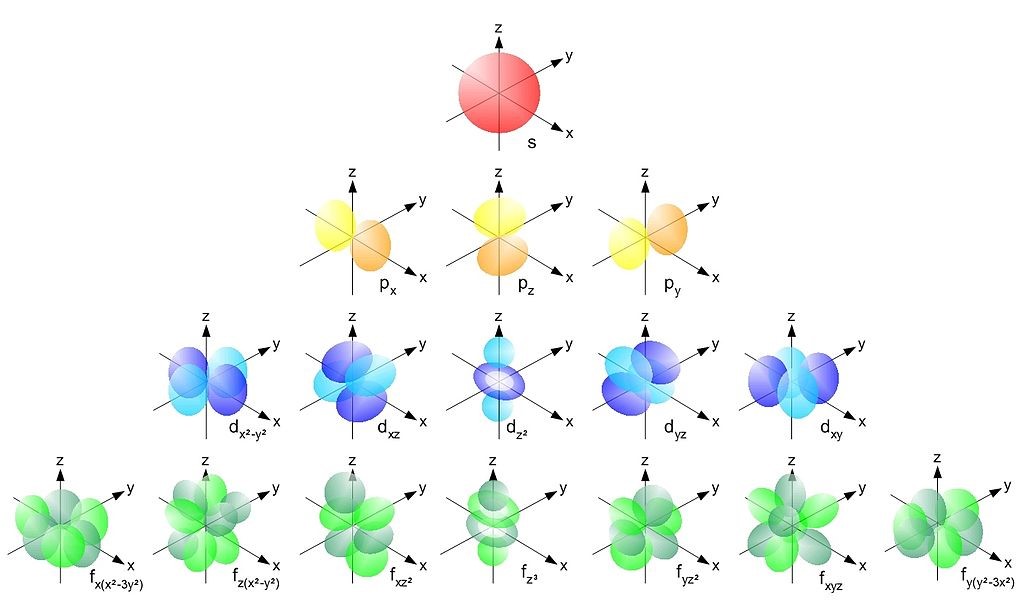
Jak se značí vedlejší kvantové číslo : Vedlejší kvantové číslo (označováno písmenem l) je závislé na hlavním kvantovém čísle (n) a jeho maximální hodnotu lze vypočítat jako l=n-1. Charakterizuje orbitální moment hybnosti elektronu a tvar (prostorovou náročnost) orbitalu. Místo čísla se často orbitaly označují písmenem: 0 – orbital typu s.
Vedlejší kvantové číslo (označováno písmenem l) je závislé na hlavním kvantovém čísle (n) a jeho maximální hodnotu lze vypočítat jako l=n-1. Charakterizuje orbitální moment hybnosti elektronu a tvar (prostorovou náročnost) orbitalu. Místo čísla se často orbitaly označují písmenem: 0 – orbital typu s.

Kvantování je ve fyzice proces, při kterém se klasické fyzikální objekty a veličiny popisující jejich chování nahrazují odpovídajícími matematickými strukturami kvantové teorie (např. operátory, vlnová funkce, stavový vektor, dráhový integrál apod.)
Jak se značí magnetické kvantové číslo
Magnetické kvantové číslo označujeme ml. Nabývá celočíselných hodnot od –l do + l, včetně nuly. Hodnota ml udává orientaci příslušného AO vůči osám x, y, z v trojrozměrném prostoru.Magnetické kvantové číslo značené m, je v atomové fyzice třetí ze sady čtyř kvantových čísel (hlavní kvantové číslo, vedlejší kvantové číslo, magnetické a spinové kvantové číslo), které popisují jedinečný kvantový stav elektronu.Spinové kvantové číslo je v atomové fyzice kvantové číslo, které parametrizuje vnitřní moment hybnosti (spinový moment hybnosti nebo prostě spin) dané částice.
VEDLEJŠÍ KVANTOVÉ ČÍSLO
Značí se l a může nabývat hodnot od 0 do n-1. Pro elektrony s hlavním kvantovým číslem n3 by to tak byly hodnoty 0, 1, 2. Toto kvantové číslo určuje tvar orbitalu. Orbital s vedlejším kvantovým číslem 0 se také označuje jako s-orbital a má tvar koule.
Jak funguje kvantování : Samotná technika se velmi těžko popisuje, protože jde především o vlastní prožitek. Stručně lze říci, že buď pomocí lektora, terapeuta nebo sami sebe si dovolíte uvolnit své tělo i mysl pomocí zaměření na svůj dech. Tím se zklidní tělo i myšlenky.
Co je to kvanta : Kvantum (z lat. quantum, „kolik“) je v kvantové fyzice nejmenší nedělitelné množství veličiny, která se podílí na interakci. Převod spojité veličiny na násobek diskrétních kvant se nazývá kvantování. Například foton je kvantum světla nebo jiného elektromagnetického záření určené Planckovou konstantou.
Co znamená kvantová
Kvantování je ve fyzice proces, při kterém se klasické fyzikální objekty a veličiny popisující jejich chování nahrazují odpovídajícími matematickými strukturami kvantové teorie (např. operátory, vlnová funkce, stavový vektor, dráhový integrál apod.)