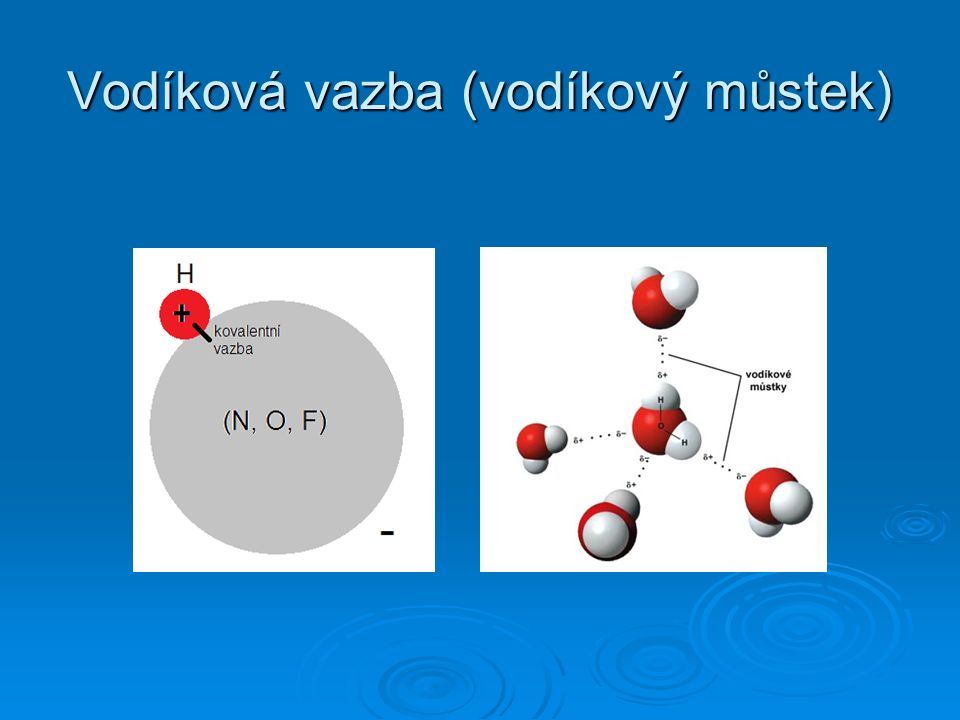
Vodíková vazba (také vodíkový můstek) je typ intermolekulární nebo intramolekulární interakce, k níž dochází sdílením vodíkových atomů. Může se uplatnit mezi molekulami, ale i v rámci dvou částí jedné molekuly. Vodíková vazba ve vodě (černé přerušované čáry).Molekuly etherů nemohou na rozdíl od alkoholů mezi sebou tvořit vodíkové můstky. To má za následek, že ethery vřou při nižší teplotě než isomerní alkoholy a jejich teplota varu se blíží teplotám varu uhlovodíků s podobnou molekulovou hmotností.Molekuly vody se díky své polaritě výrazně přitahují. Kladný konec – atom vodíku – se spojí se záporným – atomem kyslíku. Tyto vazby jsou příkladem vodíkových vazeb, slabých interakcí, ke kterým dochází mezi vodíkem s částečným kladným nábojem a více elektronegativním atomem, například kyslíkem.
Proč má voda vyšší teplotu Varů než sulfan : V podstatě platí, že s rostoucí molární hmotností látek roste teplota varu. Ale vazba vodíkovým můstkem tento obecný trend porušuje. Například voda, přestože její relativní molekulová hmotnost je 18, má podstatně větší teplotu varu než sulfan (relativní molekulová hmotnost je 34).
Co vzniká při spalování vodíku
Při spalování vodíku totiž dochází k jeho reakci s kyslíkem O2 přítomným ve vzduchu, přičemž vzniká pouze voda (H2O) ve formě páry (2H2+O2®2H2O) neškodná pro životní prostředí. Na zemi je vodík součástí mnoha látek, ze kterých ho lze různými postupy získat (voda, uhlovodíky).
Co vzniká při hoření vodíku : Při spalování vodíku vzniká vedle značného energetického zisku (96–120 MJ/kg vodíku) pouze ekologicky naprosto nezávadná voda.
Atom kyslíku O je dvojvazný, neboť obsahuje ve svém orbitalu 2p 2 nespárované elektrony. Polární vazba se vytváří mezi atomy, jejichž rozdíl hodnot elektronegativit leží v intervalu 0,4 – 1,7. Příkladem ketonů jsou také sloučeniny, u kterých je atom kyslíku O vázán přímo na uhlovodíkový cyklus.
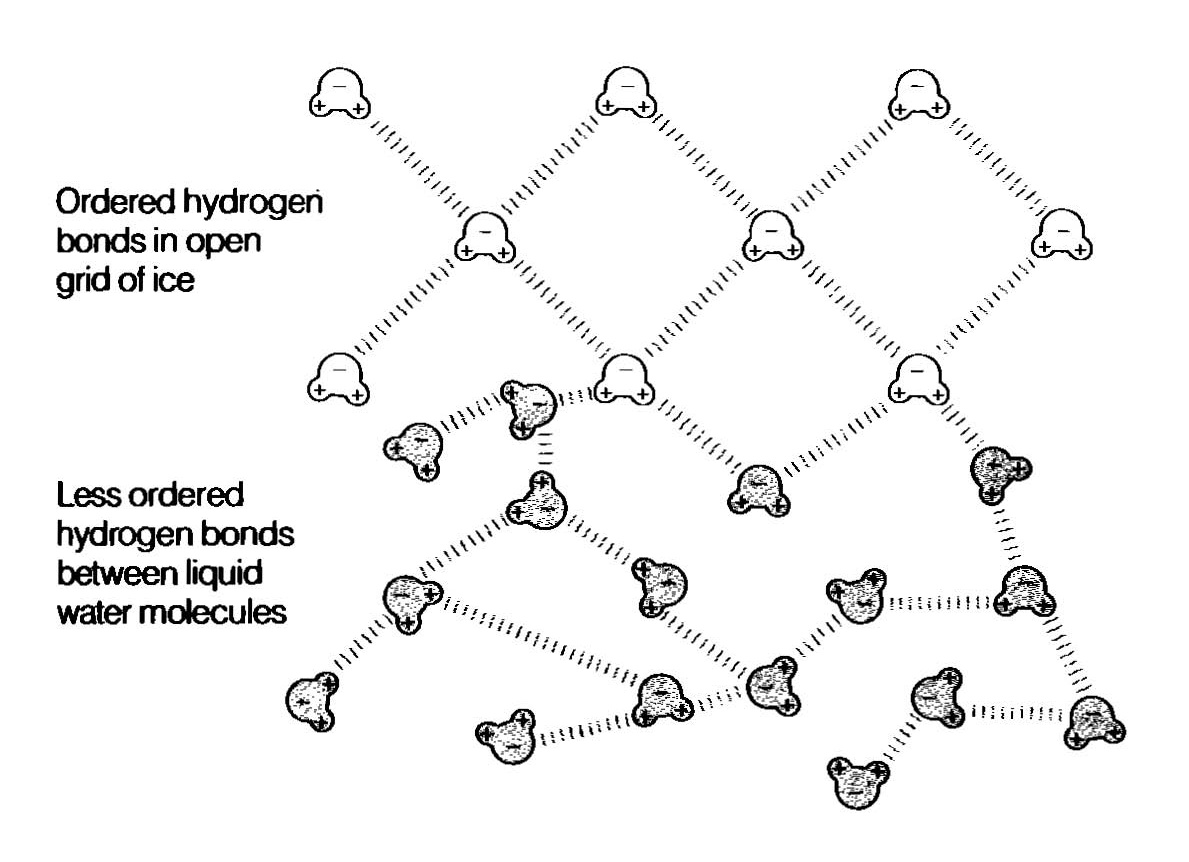
Anomální chování vody vysvětlujeme tak, že krystalická struktura ledu, která způsobuje, že led má menší hustotu než voda, se rozpadne úplně až při . V intervalu od plovou drobné krystalky ledu ve vodě a zvětšují tím její objem. Anomálie vody má velký význam pro vodní živočichy.
V kolika stupních zamrzá slaná voda
Ne tak docela. Na teplotu, při které voda zamrzá, má totiž vliv i tlak okolí nebo v ní rozpuštěné látky. Například mořská voda díky vysokému obsahu soli se mění v led při teplotě minus 2 °C.Spaliny jsou produktem spalování a nositelem uvolněného chemicky vázaného tepla a jsou směsí převážně nehořlavých plynů (N2, CO2, SO2+SO3, NOX, O2) a par (H2O), avšak mohou obsahovat i plyny hořlavé (CO, H2, CmHn), pevnou fázi (saze, popílek) a případně i fázi kapalnou (kapičky kapalného paliva, dehet, vodní kapičky).Hoření je fyzikálně chemická reakce, při které hořlavá látka reaguje vysokou rychlostí s oxidačním prostředkem za vzniku tepla a světla. Je to reakce exotermická. Při této reakci vzniká teplo, světlo (plamen) a produkty hoření (kouř).
Příčinou mohou být šok, ischemie (snížení průtoku krve tkání) nebo stagnace krve, způsobené tvorbou aterosklerotických plátů, embolií, obliterací cév, nebo srdečním selháním.
Jak reaguje vodík s kyslíkem : Hoření vodíku s kyslíkem je silně exotermní a vyvíjí teploty přes 3 000 °C. Toho se běžně využívá při svařování nebo řezání kyslíko-vodíkovým plamenem nebo v metalurgii při zpracování těžko tavitelných kovů. Vodík slouží jako chladivo alternátorů v elektrárnách.
Co způsobuje mangan ve vodě : Voda s vyšším obsahem železa je do červena a barví umyvadla, varnou konvici i prádlo. Mangan barví do šedé až černé barvy. Pokud dáte vyprat prádlo ve manganové vodě tak zešedne a s původní barvou se můžete rozloučit. Mangan v napuštěné vaně dělá na povrchu vody olejovitý vzhled.
Co způsobuje voda
Voda je základní stavební látkou celého těla, z metabolického pohledu zajišťuje správnou funkci všech procesů a orgánů v těle, jako např. termoregulační procesy, odvod toxických látek, usnadňuje trávení, celkovou regeneraci organismu atd.
Mořská voda by se v žádném případě neměla pít. Hrozí předávkování organismu solí, selhání ledvin a smrt. Světový oceán také obsahuje různé kovy, přičemž jejich významným zdrojem jsou podmořské hydrotermální prameny. V minulosti byla salinita vyšší.Základní, obecně známou vlastností vody je skutečnost, že při snížené teplotě začíná tuhnout a mění se v led. Ke změně skupenství u čisté vody za normálního tlaku dochází při teplotě 0 ℃ (273,15 Kelvina).
CO způsobuje oxid uhelnatý v těle : Při jeho nízkých koncentracích může zdravý člověk pociťovat únavu a bolest hlavy , člověk se srdečními problémy „tíži“ či bolest na prsou. Při vyšších koncentracích dochází k poruchám vidění a koordinace, silným bolestem hlavy, závratím, zmatečnému chování a může být pociťována žaludeční nevolnost.