Kationty a anionty
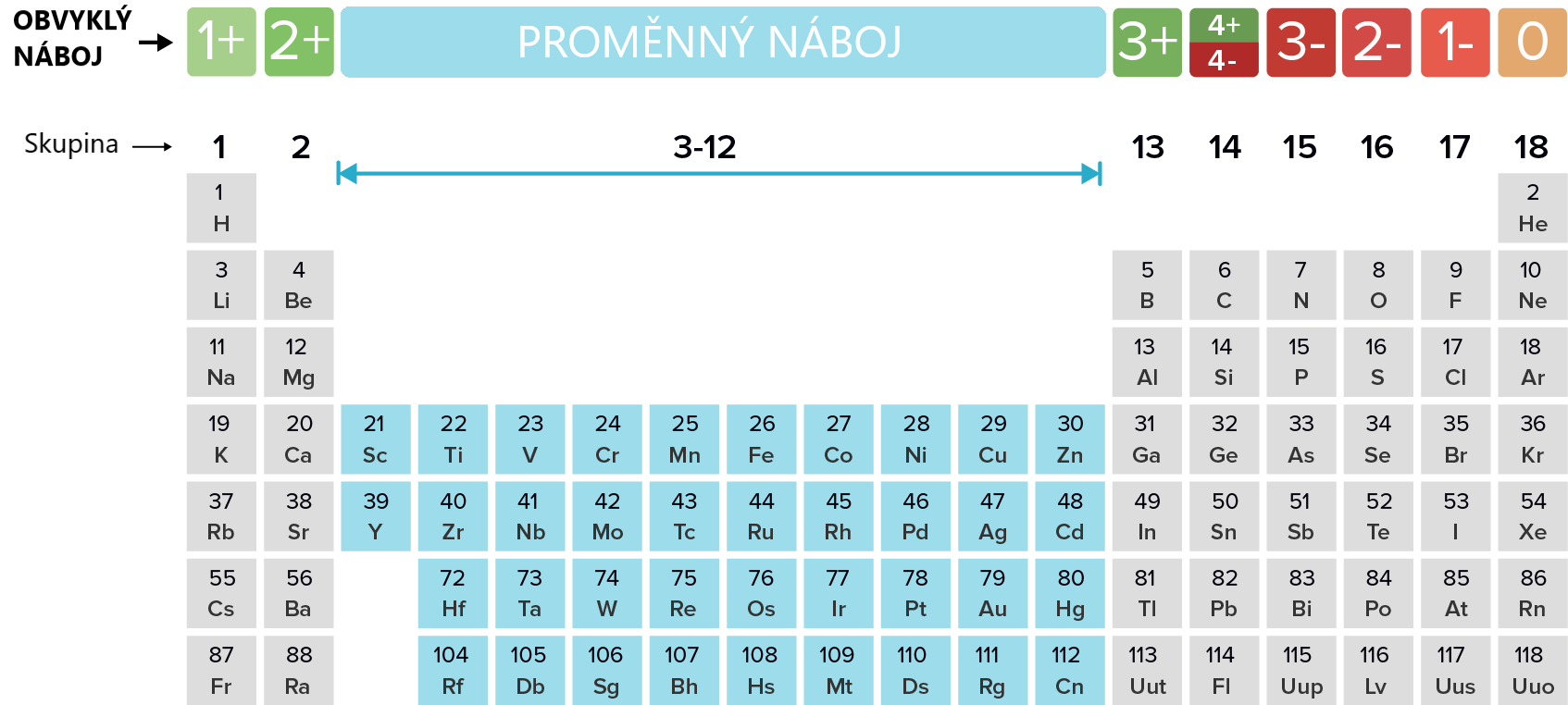
Pokud neutrální atom přijde o jeden nebo více elektronů, celkový počet elektronů se sníží, zatímco počet protonů v jádře zůstává stejný. Dojde k tomu, že se z atomu stává kation, tedy ion s kladným nábojem.Ionty jsou elektricky nabité částice, které vznikají z atomů (či molekul) přijetím či odevzdáním elektronů. Kationty jsou kladně nabité, počet elektronů v nich je nižší než počet protonů. Anionty jsou záporně nabité, počet elektronů v nich je vyšší než počet protonů.Elektricky nabité částice se nazývají ionty. Podle polarity jejich nábojů se dělí na kladně nabité ionty, kationty, např. Al3+ nebo K+, a záporně nabité ionty, anionty, např. S2- nebo OH-.
Jak poznat kation od aniontů : Ionty jsou elektricky nabité částice. Pokud jsou nabité kladně, jde o kationty, pokud záporně, jsou to anionty. Elektrický náboj se vyznačuje vpravo nahoře od značky prvku či molekuly, a to nejprve arabskou číslicí (pokud by číslice měla být 1, nepíše se) a pak pluskem (kladný náboj) nebo mínuskem (záporný náboj).
Které prvky tvoří kationty
Kationty většinou vznikají z elektropozitivních prvků, například draslíku, hořčíku nebo kobaltu: K → K+ + e−. nebo oxoniový kation z vody: H2O + H+ → H3O+.
Jak vzniká ion : Ion je částice s nábojem. Příčinou vzniku iontů z elektroneutrálních atomů je snaha o zaplněný valenční orbitál (= vrstvu). *vznikne, když dojde k odtržení 1 nebo více elektronů z valenční vrstvy neutrálního atomu.
Ionty jsou atomy, které získali nebo ztratili elektron a díky tomu jsou nabity energií. Pozitivní ionty (kationty) ztratili elektron a považují se za nezdravé. Nacházejí se v prachu, kouři a dalších toxických látkách.

Vodíkový kation (zkratka H+) je kladně nabitý iont vodíku. Vzniká formálně odtržením elektronu z atomu vodíku (prakticky nejčastěji protolýzou), tzn. jedná se ve většině případů vlastně o pouhý proton.
Co tvoří molekuly
Molekula je nejmenší částice látky, která má všechny fyzikální a chemické vlastnosti dané látky. Molekuly se skládají ze dvou nebo více atomů. Atomy tvořící molekulu mohou být stejné (např. molekula kyslíku má dva atomy kyslíku, O2) nebo různé (molekula vody má dva atomy vodíku a jeden atom kyslíku, H2O).Amoniak vzniká reakcí amonných solí se silnými hydroxidy, např. působením hydroxidu sodného na chlorid amonný: NH4Cl + NaOH → NH3 + NaCl + H2O. případně tepelným rozkladem uhličitanu amonného: (NH4)2CO3 → 2 NH3 + CO2 + H2O.Standardně se doporučuje vypít:
- 500 ml tekutin 2 hodiny před výkonem.
- 125–250 ml bezprostředně před cvičením.
- 125–250 ml každých 10–20 minut během tréninku či závodu.
- po tréninku se doporučuje vypít 150 % ztráty tekutin (např. když po tréninku vážíme o 1 kg méně, měli bychom postupně doplnit 1,5 l tekutin) [3–4]
Ion je částice s nábojem. Příčinou vzniku iontů z elektroneutrálních atomů je snaha o zaplněný valenční orbitál (= vrstvu). *vznikne, když dojde k odtržení 1 nebo více elektronů z valenční vrstvy neutrálního atomu.
Jaký prvek tvoří snadno kationty : Kationty většinou vznikají z elektropozitivních prvků, například draslíku, hořčíku nebo kobaltu: K → K+ + e−.
Co je to h3o+ : Hydronium (též hydroxoniový iont či hydroxoniový kationt) je označení pro iont H3O+, který vznikne navázáním iontu H+ na molekulu vody pomocí koordinačně-kovalentní vazby. jednotky SI a STP (25 °C, 100 kPa).
Jak vznikají molekuly
Molekula může vzniknout pouze tehdy, pokud jsou atomy, z nichž se bude skládat, vzájemně přitahovány, takže celková energie molekuly je nižší než energie samostatných atomů. Jednotlivé části molekuly (tedy atomy) drží pohromadě síly, které nazýváme chemické vazby.
Jednotkou látkového množství je 1 mol. mol Jeden mol je takové látkové množství, které obsahuje stejný počet částic, jako je počet atomů uhlíku v 12 g nuklidu 12C. Částice musí být vždy specifikována, nejčastěji v závorce za symbolem látkového množství látky, a může jí být molekula, atom, ion, elektron apod.Výskyt v přírodě
Amoniak vzniká mikrobiálním rozkladem organických zbytků, exkrementů a moči živočichů, přičemž se většinou váže ve formě amonných solí. Někteří živočichové, například ryby, vylučují většinu odpadního dusíku ve formě amoniaku. Ten je proto ve stopovém množství obsažen i v zemské atmosféře.
Co je to NH4 : N – NH4 – neboli amoniakální dusík. Jedná se o sloučeninu, která je odpadní látkou znečisťující odpadní vody. V případě, že je jeho množství příliš vysoké, může bránit celému procesu čištění. Z tohoto důvodu je důležité monitorovat a řídit jeho koncentraci v odpadních vodách.






